过渡金属氧化物
根据锂材料脱嵌机理的不同,过渡金属氧化物可分为两类。第一种类型的材料是真正意义上的锂嵌入氧化物。锂的插入只是伴随着材料结构的变化,而没有形成氧化锂。这类氧化物的代表是TiO2、WO2、MoO2、Fe2O3、Nb2O5等。这类氧化物通常具有良好的锂脱嵌可逆性,但其比容量低,锂嵌入电位高。第二种类型的过渡金属氧化物由MO(M=Co,Ni,Cu,Fe)表示。材料的锂嵌入伴随着Li2O的形成,但这不同于由上述SnO嵌入形成的非活性Li2O。电化学活性Li2O可以在类似材料的脱锂过程中脱锂,从而再次形成金属氧化物。例如,据《自然》杂志报道,纳米过渡金属氧化物MO(M=Co,Ni,Cu,Fe)作为锂离子电池的负极材料具有良好的电化学性能。
TiO2是最早被研究的金属氧化物阳极材料。它有三种不同的晶体类型。只有锐钛矿和金红石两种结构才能嵌入锂。层状金红石具有紧密堆积的六边形结构,由针状颗粒组成;锐钛矿由球形颗粒组成,具有良好的可逆锂吸收和释放性能。然而,由于极化的影响,这两种结构的TiO2在吸收和释放锂的过程中存在潜在的滞后现象。
使用Fe2O3作为负极材料形成Li6Fe2O3,理论容量为1000mA·h/g。对不同形貌的α-Fe2O3的电化学性能的研究结果表明,非晶态结构的循环性能不如纳米晶结构。由于其粒径小、比表面积大,电解质更容易在其表面分解形成SEI膜,阻碍了锂在α-Fe2O3电极上的吸附和电化学反应。
P.Polzot等人合成了一系列纳米过渡金属氧化物Co3O4、CoO、FeO、NiO等。研究发现,纳米CoO和Co3O4电极的比容量为700~800mA·h/g,循环次数为100次。第二次之后,其容量保持在100%左右。然而,这种类型的3d过渡金属氧化物属于岩盐相结构,不存在用于插入锂离子的空位。因此,锂存储机制可以被认为是当充电时锂和过渡金属氧化物结中的氧都形成Li2O,并且当放电时Li2O再次还原为锂,并且过渡金属氧化物再生。以CoO为例,主要反应过程如下:
CoO+2Li↔Li2O+Co
过渡金属氧化物阳极材料(Co3O4、Co0、FeO、NiO)具有600~1000mA·h/g的高比容量,并且密度大,能够承受更高功率的充放电。然而,这种类型的材料的主要缺点是其较高的工作潜力。在实际应用中,由正极材料组成的电池的电压相对较低。例如,由CoO和LiMn2O4组成的电池的平均电压仅为2.2V。
由于Fe2O3和MO(M=Cu,Ni,Co)都可以储存锂,因此它们被制备成复合铁氧体氧化物(MFe2O4,M=Cu、Ni,Co。这方面的机制也在讨论之中。有人研究了MnV2O6和MnMoO4氧化物的脱嵌特性。它们的可逆容量高达800~1000mA·h/g,但循环性能有待提高。该材料首次嵌入锂后,其结构变为无定形形式,很难简单通过金属价态的变化来解释如此高的容量,因此具体机制需要进一步研究。
过渡金属钒酸盐
过渡金属钒酸盐(M-V-O,M=Cd,Co,Zn,Ni,Cu,Mg)用作锂离子电池的负极材料,并且在相对于锂的低电势下表现出高容量。当电压低于0.2V时,可以可逆地插入7Li,容量达到800~900mA·h/g,是石墨电极容量的两倍多。在第一次锂化过程中,该电极材料将变得非晶化,使得第一次放电(电压逐步变化)和第二次放电(电流平滑且连续)的电压组成曲线不同。
这在实际电池使用过程中是不利的。另一种类型的钒酸盐RVO4(R=In,Cr,Fe,Al,Y)用作锂离子电池的负极材料,其可以在低电压下与锂反应。其中,InVO4和FeVO4具有高达900mA·h/g的可逆容量。与晶态材料相比,非晶态材料具有更好的电化学性能。这种材料目前的问题是循环性能仍需改进。
硫化物
TiS2、MoS2等硫化物也可以用作锂离子电池的负极材料,并可以与LiCoO2、LiNiO2和LiMn2O4等4V级正极材料匹配形成电池。这种类型的电池电压低。例如,TiS2被用作负电极,LiCoO2被用作正电极以形成电池。电压约为2V,其循环性能更好,可达到500倍。

磷酸盐
在许多含氮材料中,对氮化物(稍后描述)和锑化物的储锂性能的研究相对较多。然而,砷化合物通常是有毒的,因此没有相关报告。磷资源丰富,价格低廉。磷的原子量比锑小,其锂存储容量更高。在磷化物方面,研究的磷化物包括MnP4、CoP3、FeP2和Li7MP4(M=Ti、V、Mn)等体系。
将红磷、金属锰粉和锡粉在手套箱中按一定比例(Mn:P:Sn=1:10:6)混合,转移到石英管中,在真空条件下于550~650℃加热两周。经过1+1盐酸处理,最终得到MnP4材料。对材料电化学性能的研究表明,MnP4的第一条锂插入曲线在0.62V附近呈现出非常平坦的电压平台,这对应于7个锂的插入。当第一次脱锂达到1.7V时,相当于去除了5个锂,可逆脱锂容量约为700mA·h/g。经过50次循环后,容量稳定在350mA·h/g左右。脱嵌锂的过程是:
MnP4+7Li↔LiMnP4
锂的释放过程伴随着P-P键的断裂和复合。
有些人将红磷和金属钴按一定比例(Co:P=1:3)密封在充满氩气的不锈钢管中,并在650°C下加热24小时,以获得CoP3材料。CoP3的充放电曲线如图1所示。
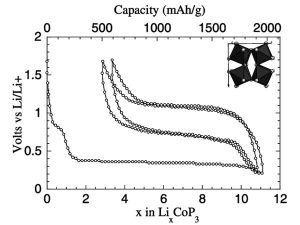
锂的插入首次具有大约0.35V的电压平台,这对应于9个锂的插入。第一次脱锂至1.7V相当于去除了6个锂,可逆脱锂容量大于1000mA·h/g,经过10次充放电循环后,其衰减至600mA·h/g,最终容量稳定在400mA·h/g/g左右。研究表明,锂的CoP3脱嵌机理与MnP4脱嵌机理完全不同。锂的第一次嵌入伴随着金属钴和磷化锂Li3P的形成,而随后的脱嵌过程在Li3P和LiP之间进行。钴的价态没有改变。
CoP3+9Li→3Li3P+Co
3Li3P↔3LiP+6Li
磷化物的电化学性能通常是前几次锂脱嵌容量相对较高,但循环性能和首次充放电效率相对较低。它们脱嵌锂的机制不同,磷化物有一个共同点:脱嵌锂时,磷价态的变化对维持系统的电荷平衡起着重要作用。