锂离子电池作为一种电化学储能装置,本质上是电能和化学能相互转换的过程。以商用锂钴氧化物(LiCoO2)/中相碳微球石墨(MCMB)电池为例。在电池的充电过程中,从外部施加的电压差导致Li+从正极材料中脱落,并且电解质穿透隔膜以插入电池中。在负极材料中;同时,电子通过外部电路从正极流向负极。
在此期间,当从正极提取锂离子时,负极的电化学电势(对于Li/Li﹢) 随着Li的插入,负极的电化学电势增加, 从而在正极和负极之间产生电化学电势差,电池电压持续增加到充电截止电压(当正极LiCoO2材料达到4.2V vs.C时)。
当外部负载施加到电池以放电时,由于电极之间的电化学电势差,Li﹢ 从负电极扩散到正电极并且电子通过外部负载从负电极流到正电极。在这个过程中,电池电压和电极电势随着电池放电而变化,当Li﹢ 正极的电化学电势相对于Li/Li﹢ 随着Li的释放,负极的电化学电势降低, 导致电池电压持续降低,直到电压(正极LiCoO2材料达到3.0V vs.C)结束时,停止放电。
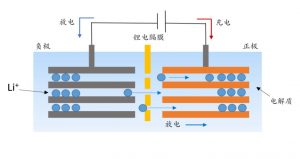
总之,锂离子电池的充放电过程是通过锂离子在正负电极之间的穿梭来实现的,因此锂离子电池也被称为“摇椅电池”。以锂离子电池系统的正极材料LiCoO2和负极材料石墨为例,示出了电池材料在充电和放电期间的反应。充电时,LI﹢ 从LiCoO2材料释放并释放电子。Co3﹢ 被氧化成Co4﹢ , 当Li﹢ 插入其层之间。
因此,在充电过程中,正极处于贫锂状态,负极石墨处于富锂状态。相应地,在放电期间,LI﹢ 从石墨层释放并嵌入正极材料中,而正极材料获得电子,Co﹢ 还原为Co3﹢, 正极变为富锂状态并且石墨负极返回到贫锂状态。正电极和负电极在充电和放电过程中的反应方程式如下;
正极反应:LiCoO2⇄ Li1-xCoO2+xLi﹢ + xe
负极反应:Cn+xLi﹢ + xe⇄ LixCn
电池总反应:LiCoO2+Cn⇄ Li1-xCoO2+LixCn
在锂离子电池系统中,锂离子在正极和负极之间的转移本质上是浓度差扩散。理论上,LI﹢的插入和抽出 不会对电极材料的晶体结构造成损坏。从这个意义上讲,从上述观点来看,锂离子电池反应可以被视为一种理想的可逆反应。